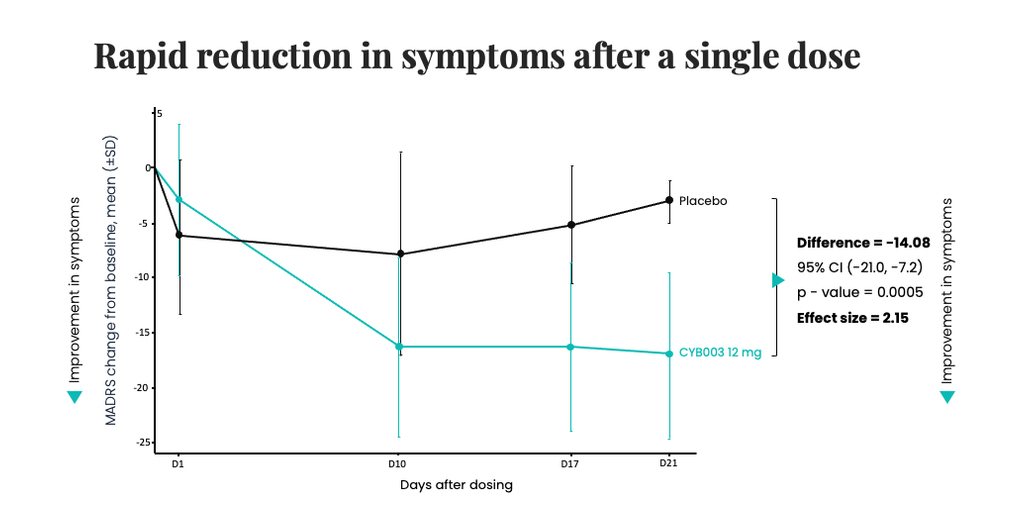
– Zwischenergebnisse zeigen eine rasche, eindeutige und klinisch signifikante Verbesserung der Depressionssymptome drei Wochen nach einer Einzeldosis von 12 mg, mit einer beispiellosen durchschnittlichen Verbesserung von -14 Punkten auf der Montgomery-Åsberg-Depressionsskala (MADRS) im Vergleich zum Ausgangswert zwischen CYB003 (12 mg) und Placebo (p= 0,0005) –
– Anhand von gepoolten Referenzdaten aus 232 Studien zu aktuellen Standard-Antidepressiva, den selektiven Serotonin-Wiederaufnahme-Hemmern (SSRI), die bei der US-amerikanischen Food and Drug Administration (FDA) eingereicht wurden (Stone et al., 2022), wurde eine durchschnittliche Verbesserung von 1,82 Punkten im Vergleich zu Placebo ermittelt –
– Robustes Ansprechen und Remission drei Wochen nach der Einzeldosis: 53,3 % der Patienten sprachen an, und 20 % der Patienten waren in Remission (erfüllten nicht mehr die klinische Definition einer Depression), im Vergleich zu 0 % bei Placebo –
– Günstiges Sicherheits- und Verträglichkeitsprofil ohne behandlungsbedingte schwerwiegende unerwünschte Ereignisse bei Einzeldosis von 12 mg –
– Veröffentlichung der vollständigen Topline-Daten voraussichtlich im vierten Quartal 2023 –
– Am Mittwoch, 1. November 2023, richtet das Unternehmen um 11.00 Uhr ET eine Konferenzschaltung zu den Zwischenergebnissen für CYB003 ein –
Diese Pressemitteilung ist eine „ausgewiesene Pressemitteilung“ für die Zwecke der Prospektunterlagen von Cybin, datiert vom 23. August 2023, zur Kurzfassung des Basisprospekts vom 17. August 2023.
TORONTO, Kanada–(BUSINESS WIRE)–Cybin Inc. (NYSE American:CYBN) (NEO:CYBN) („Cybin“ oder das „Unternehmen“), ein auf die klinische Phase spezialisiertes Biopharma-Unternehmen, das die psychische Gesundheitsversorgung durch die Entwicklung neuer und innovativer psychedelischer Behandlungsmöglichkeiten revolutionieren will, gab heute die Phase-2-Zwischenergebnisse zu seinem proprietären deuterierten Psilocybin-Analogon CYB003 bekannt, die eine rasche, robuste und statistisch signifikante Verringerung der Depressionssymptome drei Wochen nach einer 12-mg-Einzeldosis im Vergleich zu Placebo zeigen. Beim primären 3-Wochen-Wirksamkeitsendpunkt war die Verringerung der Symptome der klinischen Depression („MDD“), definiert als Verbesserung des MADRS-Gesamtscores gegenüber dem Ausgangswert bei den Teilnehmern, die CYB003 erhielten, im Vergleich zu den Teilnehmern, die Placebo erhielten, um 14,08 Punkte (p=0,0005, Cohen’s d=2,15). Der p-Wert zeigt die statistische Signifikanz an. Im Allgemeinen gelten Werte <0,05 als statistisch signifikant und Werte <0,001 als statistisch hoch signifikant.
„Die eindeutig positiven Zwischenergebnisse für die 12-mg-Dosis von CYB003 sind sehr ermutigend für Patienten und medizinische Fachkräfte. Die nachgewiesene Wirksamkeit bei dieser Dosierung zeigt eine beispiellose Verringerung der depressiven Symptome im Vergleich zu den bisher verfügbaren Therapien“, so Doug Drysdale, Chief Executive Officer bei Cybin. „Angesichts dieser ermutigenden Ergebnisse freuen wir uns darauf, im weiteren Verlauf dieses Quartals die umfassenden Topline-Daten und im ersten Quartal 2024 die 12-Wochen-Daten zu veröffentlichen. Unsere weiteren Planungen sehen eine umfangreiche internationale, standortübergreifende Phase-3-Studie Anfang 2024 vor, um die Sicherheit und Wirksamkeit von CYB003 bei Patienten mit MDD weiter zu untersuchen.“
In der klinischen Phase-2-Studie wird die Wirksamkeit anhand der MADRS-Skala untersucht, wobei als primärer Wirksamkeitsendpunkt die Verringerung der Depressionssymptome (Veränderung des MADRS-Wertes gegenüber dem Ausgangswert) in Woche 3 nach einmaliger Verabreichung definiert wurde. Die Verabreichung wurde in allen Kohorten bis zu einer Dosis von 16 mg abgeschlossen. Dabei wurden ein günstiges Sicherheits- und Verträglichkeitsprofil festgestellt und keine behandlungsbedingten schwerwiegenden unerwünschten Ereignisse beobachtet. Zwischenergebnisse aus der Kohorte mit einer Dosis von 12 mg haben eine statistisch signifikante und klinisch relevante Verringerung der Depressionssymptome drei Wochen nach Verabreichung einer Einzeldosis gezeigt.
Die MADRS ist eine Skala zur Fremdbeurteilung der depressiven Symptome bei Patienten mit MDD durch einen Klinikarzt anhand von 10 Fragen. Sie wird in klinischen Studien weithin eingesetzt und von den Zulassungsbehörden weltweit zur Bewertung der Symptome einer Depression akzeptiert. Die MADRS umfasst Fragen, die von trauriger Stimmung, Schlaf- und Appetitminderung bis hin zu Konzentrationsschwierigkeiten, Anhedonie sowie negativen und suizidalen Gedanken reichen und mit Punkten von 0 bis 6 bewertet werden, die einen Gesamtwert zwischen 0 und 60 ergeben. Typische Bewertungsbereiche für den Schweregrad sind: 0-6 normal, 7-19 leicht, 20-34 mäßig und >34 schwer depressiv. In der CYB003-Studie betrugen die mittleren MADRS-Ausgangswerte in der aktiven und der Placebo-Gruppe 32,6 bzw. 33,3.
Zusammenfassung der vorläufigen Wirksamkeitsdaten von CYB003 12 mg nach drei Wochen:
-
Schnelle und statistisch signifikante Verbesserung der Depressionssymptome nach einmaliger Verabreichung von CYB003:
- Verbesserung der Depressionssymptome am Tag nach der Einnahme nachweisbar, die 10 Tage nach der Einnahme ihren Höhepunkt erreicht und danach anhält
- Robuste und statistisch signifikante Verbesserung der Depressionssymptome im Vergleich zu Placebo nach 3 Wochen, mit einem Unterschied von -14,08 gegenüber dem MADRS-Ausgangswert für CYB003 im Vergleich zu Placebo (p=0,0005)
-
Robuste Ansprech- (Verbesserung des MADRS-Werts um ≥50 %) und Remissionsraten (MADRS-Wert ≤10) drei Wochen nach Verabreichung der Einzeldosis:
- Ansprechrate für CYB003 (12mg) von 53,3 % vs. 0 % für Placebo
- Remissionsrate für CYB003 (12mg) 20,0 % vs. 0 % für Placebo
Sicherheit und Verträglichkeit:
- CYB003 wurde gut vertragen. Es wurden keine schwerwiegenden unerwünschten Ereignisse im Zusammenhang mit dem Medikament beobachtet
- Alle unerwünschten Ereignisse waren von leichter oder mittlerer Intensität und verschwanden spontan ohne Intervention
„Diese positiven Zwischenergebnisse zur Sicherheit und Wirksamkeit unterstützen die Aufnahme von Zulassungsstudien. Wir planen, zum Abschluss der Phase 2 Anfang 2024 eine FDA-Sitzung zu beantragen, um das Design der Phase-3-Studie abzustimmen. Wir beginnen mit der Dosierung einer Kapselformulierung von CYB003 in der Bioäquivalenzkohorte und der weiteren Herstellung von GMP-konformen Materialien, die dosisflexibel, patientenfreundlich und kommerziell skalierbar sein werden. Dies ist ein spannender Moment – nicht nur für Cybin, sondern den gesamten Psychedelika-Sektor –, da uns jetzt Zwischenergebnisse vorliegen, die eine signifikante Verbesserung der Depressionssymptome nach einer einzigen Dosis belegen. Dies bringt uns unserem Ziel, das Angebot an Behandlungsoptionen für das gesamte Spektrum der psychischen Erkrankungen zu verbessern, ein großes Stück näher“, berichtet Drysdale.
Amir Inamdar, Chief Medical Officer bei Cybin, kommentiert: „Psychische Störungen betreffen fast eine Milliarde Menschen weltweit. Komorbide MDD tritt häufig bei medizinischen und psychiatrischen Störungen auf, darunter Angststörungen und posttraumatische Belastungsstörungen. Diese Zwischenergebnisse sowie neue Daten aus mehreren akademischen Studien deuten darauf hin, dass CYB003 bei einer Reihe von psychischen Erkrankungen wirksam sein könnte.“
Nächste Meilensteine:
Die vollständigen Daten zur Sicherheit und Wirksamkeit aus der CYB003 MDD-Studie werden gegen Ende des vierten Quartals 2023 erwartet. Die 12-Wochen-Daten werden voraussichtlich im ersten Quartal 2024 veröffentlicht. Cybin plant, diese ersten Daten bei der FDA einzureichen und nach Abschluss der Phase 2 im ersten Quartal 2024 eine FDA-Sitzung zu beantragen. Die Patientenanmeldung für eine CYB003-Phase-3-Studie dürfte Ende des ersten Quartals 2024 starten.
Das Unternehmen erwartet außerdem, noch vor Ende 2023 erste Phase-1-Daten für CYB004 und SPL028, seine neuartigen deuterierten N,N-Dimethyltryptamin-Verbindungen („DMT“), präsentieren zu können, die den Beginn einer Phase-2-Studie im ersten Quartal 2024 mit Teilnehmern unterstützen, die an einer allgemeinen Angststörung leiden.
Hinweise zur Konferenzschaltung und zum Webcast:
|
Datum: |
Mittwoch, 1. November 2023 |
||
|
|
|
||
|
Uhrzeit: |
11.00 Uhr ET |
||
|
|
|
||
|
Einwahl: |
800-245-3047 (gebührenfrei in den USA) oder 203-518-9765 (international) |
||
|
|
|
||
|
Konferenz-ID: |
CYBN1101 |
||
|
|
|
||
|
Webcast: |
Registrieren Sie sich hier für den Webcast |
Der archivierte Webcast wird auch auf der Investor-Relations-Website von Cybin auf der Seite Events and Presentations verfügbar sein.
Über die Phase-1/2-Studie zu CYB003
Bei der Phase-1/2-Studie handelt es sich um eine randomisierte, doppelblinde, placebokontrollierte Studie, in der CYB003 bei Teilnehmern mit mäßiger bis schwerer klinischer Depression (MDD) und bei gesunden Probanden untersucht wird. Teilnehmer mit MDD erhielten zwei Verabreichungen (Placebo/aktiv und aktiv/aktiv) im Abstand von drei Wochen. Das Ansprechen bzw. die Remission wird drei Wochen nach jeder Verabreichung bewertet. MDD-Teilnehmer, die derzeit mit Antidepressiva behandelt werden, dürfen ihr Antidepressivum weiter einnehmen.
Die Studie untersucht die Sicherheit, Verträglichkeit, Pharmakokinetik und Pharmakodynamik sowie die psychedelische Wirkung aufsteigender oraler Verabreichungen von CYB003. Bei Teilnehmern mit MDD wird in der Studie das schnelle Einsetzen der antidepressiven Wirkung am Tag der Verabreichung anhand der MADRS bewertet, um den zusätzlichen Nutzen einer zweiten CYB003-Dosis in Woche 3 zu ermitteln. Ein fakultativer Beurteilungszeitraum wird dazu beitragen, die Dauer des Behandlungseffekts nach 12 Wochen zu bewerten. Die Studie ist auf ClinicalTrials.gov aufgeführt unter der Kennung: NCT05385783.
Über Cybin
Cybin ist ein auf die klinische Phase spezialisiertes Biopharma-Unternehmen, das sich zum Ziel gesetzt hat, sichere und wirksame Therapeutika auf psychedelischer Basis zu entwickeln, die den großen ungedeckten Bedarf an neuen und innovativen Behandlungsmöglichkeiten für Menschen decken, die unter psychischen Erkrankungen leiden.
Das Ziel von Cybin, die psychische Gesundheitsversorgung zu revolutionieren, wird durch ein Netzwerk von erstklassigen Partnern und international anerkannten Wissenschaftlern unterstützt und dient dazu, eigene Plattformen zur Entdeckung von Medikamenten, innovative Verabreichungssysteme sowie neuartige Formulierungsansätze und Behandlungsmethoden voranzubringen. Derzeit arbeitet das Unternehmen an der Entwicklung von CYB003, einem patentrechtlich geschützten deuterierten Psilocybin-Analogon zur Behandlung von schweren depressiven Störungen, und CYB004, einem patentrechtlich geschützten deuterierten DMT-Molekül zur Behandlung von allgemeinen Angststörungen. Darüber hinaus verfügt Cybin über eine Forschungspipeline mit psychedelisch wirksamen Substanzen.
Cybin wurde 2019 gegründet und hat seinen Hauptsitz in Kanada. Das Unternehmen ist in Kanada, den USA, Großbritannien, den Niederlanden und Irland tätig. Aktuelle Nachrichten des Unternehmens und weitere Informationen über Cybin finden Sie unter www.cybin.com. Folgen Sie dem Team auf Twitter, LinkedIn, YouTube und Instagram.
Warnhinweise und zukunftsgerichtete Aussagen
Bestimmte Aussagen in dieser Pressemitteilung in Bezug auf das Unternehmen sind zukunftsgerichtete Aussagen und haben einen prospektiven Charakter. Zukunftsgerichtete Aussagen beruhen nicht auf historischen Fakten, sondern auf derzeitigen Erwartungen und Prognosen in Bezug auf zukünftige Ereignisse und unterliegen daher Risiken und Unwägbarkeiten, die zur Folge haben können, dass die tatsächlichen Ergebnisse erheblich von den in den zukunftsgerichteten Aussagen ausgedrückten oder implizierten Ergebnissen abweichen. Diese Aussagen sind im Allgemeinen an der Verwendung von zukunftsgerichteten Begriffen wie „können“, „sollten“, „könnten“, „beabsichtigen“, „schätzen“, „planen“, „antizipieren“, „erwarten“, „glauben“ oder „fortsetzen“ bzw. deren Verneinung oder ähnlichen Varianten zu erkennen. Zu den zukunftsgerichteten Aussagen dieser Pressemitteilung gehören Aussagen zu Cybins Plänen, bis Ende 2023 die Sicherheits- und Wirksamkeitsdaten der Phase 2 seines CYB003-Programms für deuteriertes Psilocybin-Analogon zu veröffentlichen; die Veröffentlichung der 12-Wochen-Daten zu CYB003 im ersten Quartal 2024; der Übergang in Phase 3 der CYB003-Entwicklung Anfang 2024; die Patientenanmeldung für eine CYB003-Phase-3-Studie und der Start der Phase-3-Studie zum Ende des ersten Quartals 2024; der Plan des Unternehmens, Anfang 2024 eine Sitzung mit der FDA zum Abschluss der Phase 2 zu beantragen; die Präsentation der Topline-Daten der Phase 1 zu CYB004 und SPL028, die proprietären neuartigen deuterierten DMT-Verbindungen, vor dem Jahresende 2023; der Beginn einer Phase-2-Studie zu den proprietären neuartigen deuterierten DMT-Verbindungen bei Patienten mit allgemeiner Angststörung im ersten Quartal 2024; und die proprietären Plattformen zur Entdeckung von Arzneimitteln, innovativen Verabreichungssystemen, neuartigen Formulierungsansätzen und Behandlungsschemata für psychische Störungen.
Diese zukunftsgerichteten Aussagen gründen auf angemessenen Annahmen und Einschätzungen des Managements von Cybin zu dem Zeitpunkt, als diese Aussagen getätigt wurden. Die tatsächlichen zukünftigen Ergebnisse können erheblich von ihnen abweichen, da zukunftsgerichtete Aussagen bekannte und unbekannte Risiken, Ungewissheiten und andere Faktoren beinhalten, die dazu führen können, dass die tatsächlichen Ergebnisse, Leistungen oder Erfolge des Unternehmens sich grundlegend von den zukünftigen Ergebnissen, Leistungen oder Erfolgen unterscheiden, die in diesen zukunftsgerichteten Aussagen ausgedrückt oder impliziert werden. Zu diesen Faktoren gehören unter anderem: Auswirkungen der Verbreitung von COVID-19 auf die Geschäftstätigkeit des Unternehmens; Veränderungen der makroökonomischen Rahmenbedingungen; Fluktuationen der Wertpapiermärkte; Erwartungen hinsichtlich des Marktpotenzials für Psychedelika; die Fähigkeit des Unternehmens, seine Geschäftsziele erfolgreich umzusetzen; Wachstumspläne; politische, soziale und umweltbezogene Unwägbarkeiten; die Mitarbeiterbindung; Gesetzen und Verordnungen, die in den Märkten, in denen das Unternehmen tätig ist, Beschränkungen auferlegen könnten; und die Risikofaktoren, die im Bericht des Managements des Unternehmens für die drei Monate bis zum 30. Juni 2023 sowie im Jahresbericht des Unternehmens für das Geschäftsjahr bis zum 31. März 2023 beschrieben sind, die im Profil des Unternehmens auf SEDAR+ unter www.sedarplus.ca und bei der U.S. Securities and Exchange Commission auf EDGAR unter www.sec.gov verfügbar sind. Obwohl die in dieser Pressemitteilung enthaltenen zukunftsgerichteten Aussagen auf Annahmen beruhen, die das Management des Unternehmens für angemessen hält oder zu diesem Zeitpunkt für angemessen hielt, kann das Unternehmen den Aktionären nicht garantieren, dass die tatsächlichen Ergebnisse mit diesen zukunftsgerichteten Aussagen übereinstimmen werden, da andere Faktoren dazu führen können, dass die Ergebnisse anders als von uns erwartet, geschätzt oder beabsichtigt ausfallen. Die Leser sollten sich nicht in unangemessener Weise auf die in dieser Pressemitteilung enthaltenen zukunftsgerichteten Aussagen und Informationen verlassen. Das Unternehmen übernimmt keinerlei Verpflichtung, die zukunftsgerichteten Aussagen in Bezug auf Ansichten, Meinungen, Prognosen oder andere Faktoren zu aktualisieren, sollten sich diese ändern, sofern dies nicht gesetzlich vorgeschrieben ist.
Cybin trifft keine medizinischen, therapeutischen oder gesundheitsfördernden Aussagen über die von Cybin angebotenen Produkte. Die U.S. Food and Drug Administration, Health Canada oder andere vergleichbare Aufsichtsbehörden haben Aussagen zu Psilocybin, psychedelischen Tryptaminen, Tryptaminderivaten oder anderen psychedelischen Verbindungen nicht bewertet. Die Wirksamkeit dieser Produkte ist nicht durch anerkannte Forschungsarbeiten bestätigt worden. Es besteht keine Garantie, dass die Verwendung von Psilocybin, psychedelischen Tryptaminen, Tryptaminderivaten oder anderen psychedelischen Verbindungen eine Krankheit oder einen Zustand diagnostizieren, behandeln, heilen oder verhindern kann. Es bedarf gründlicher wissenschaftlicher Forschung und klinischer Studien. Cybin hat keine klinischen Studien für die Verwendung seiner angebotenen Produkte durchgeführt. Jegliche Verweise auf die Qualität, Konsistenz, Wirksamkeit und Sicherheit potenzieller Produkte lassen nicht den Schluss zu, dass Cybin diese Produkte in klinischen Studien überprüft habe oder derartige Studien durchführen werde. Sollte Cybin nicht dazu in der Lage sein, die für die Kommerzialisierung ihres Geschäfts erforderlichen Zulassungen zu erhalten oder entsprechende Forschungsergebnisse vorzulegen, könnte sich dies in erheblichem Maße nachteilig auf die Performance und die Geschäftstätigkeit von Cybin auswirken.
Weder die Neo Exchange Inc. noch die NYSE American LLC haben den Inhalt dieser Pressemitteilung genehmigt oder abgelehnt und sind nicht verantwortlich für die Angemessenheit und Richtigkeit des Inhalts dieser Mitteilung.
Fußnoten
- FETZIMA® ist eine eingetragene Marke von Allergan Sales, LLC, einem Unternehmen von AbbVie. VIIBRYD® ist eine eingetragene Marke von Allergan Sales, LLC, einem Unternehmen von AbbVie. TRINTELLIX®, ehemals BRINTELLIX, ist eine beim U.S. Patent and Trademark Office eingetragene Marke von H. Lundbeck A/S, die von Takeda Pharmaceuticals America, Inc. unter Lizenz verwendet wird. VRAYLAR® ist eine Marke von Allergan Pharmaceuticals International Limited, einem Unternehmen von AbbVie. AUVELITY® ist eine eingetragene Marke von Axsome Therapeutics, Inc. SPRAVATO® ist eine eingetragene Marke der Johnson & Johnson Corporation. Die hier genannten Marken Dritter sind Marken der jeweiligen Eigentümer.
Die Ausgangssprache, in der der Originaltext veröffentlicht wird, ist die offizielle und autorisierte Version. Übersetzungen werden zur besseren Verständigung mitgeliefert. Nur die Sprachversion, die im Original veröffentlicht wurde, ist rechtsgültig. Gleichen Sie deshalb Übersetzungen mit der originalen Sprachversion der Veröffentlichung ab.
Contacts
Kontakt für Investoren und Medien:
Gabriel Fahel
Chief Legal Officer
Cybin Inc.
1-866-292-4601
irteam@cybin.com oder media@cybin.com