DANVERS, Massachusetts–(BUSINESS WIRE)–Abiomed (NASDAQ: ABMD) gibt die Zulassung der Impella ECP durch die US-amerikanische Food and Drug Administration (FDA) bekannt. Die Genehmigung bezieht sich auf die Version der Impella ECP, die in der zulassungsrelevanten Impella ECP-Studie verwendet werden soll. Für diese Studie wurden nun die ersten beiden Patienten angemeldet. Amir Kaki, MD, Direktor der Abteilung für mechanische Kreislaufunterstützung am Ascension St. John Hospital in Detroit, leitete die Verfahren. Bei dieser einarmigen, prospektiven, multizentrischen Studie wird die Häufigkeit der schwerwiegenden unerwünschten kardiovaskulären und zerebrovaskulären Ereignisse (MACCE) bei erwachsenen Patienten evaluiert, die während einer elektiven oder dringenden perkutanen Hochrisiko-Koronarintervention (PCI) mit Impella ECP unterstützt werden.
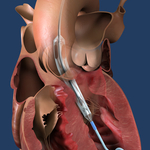
Impella ECP ist die kleinste Herzpumpe der Welt und bisher die einzige, die mit kleinkalibrigen Zugangsstellen und Verschlusstechniken kompatibel ist. Beim Einsetzen und Entnehmen aus dem Körper weist sie einen Durchmesser von 9 Charrière (Charr) auf. Im Herzen dehnt sie sich aus und unterstützt die Pumpfunktion des Herzens bei Spitzenvolumenströmen von mehr als 5 l/min.
Beide Patienten, die an der Studie teilnahmen, erhielten eine Unterstützung durch die Impella ECP während eines anspruchsvollen koronaren Bifurkationsstent-Eingriffs an der linken Hauptschlagader mit stark verkalkten Läsionen. Nach dem Entfernen der Impella ECP wurde der erste Patient mit einem 8-Charr-Verschlussgerät verschlossen.
„Die Forschungs- und Klinikteams am Ascension St. John begrüßen die Aufnahme der ersten Patienten in die Impella ECP-FDA-Zulassungsstudie“, berichtet Dr. Kaki, der leitende Studienarzt auf nationaler Ebene. „Die Impella ECP ermöglicht Ärzten, eine kritische hämodynamische Unterstützung bei Hochrisiko-PCI-Eingriffen zu gewährleisten, indem sie im Vergleich zu anderen Optionen einen ähnlichen oder höheren Volumenstrom durch eine kleinere Einführschleuse erzielt. Diese Technologie besitzt das Potenzial, die Sicherheit der Patienten und den Durchsatz im Katheterlabor zu verbessern, da für die Pumpenplatzierung eine geringere Arteriotomie erforderlich ist.“
„Impella ECP unterstreicht die technologische Führungsrolle und Innovationskraft von Abiomed. Mit der Entwicklung der kleinsten Herzpumpe der Welt haben wir die kleinkalibrige Barriere durchbrochen“, so Mike Minogue, Chairman, President und Chief Executive Officer bei Abiomed. „Bei Abiomed streben wir an, kleinere, intelligentere und umfassender vernetzte Technologien zu entwickeln, die die Behandlungsergebnisse für Patienten mit Herzkrankheiten verbessern. Ich beglückwünsche die Teams der medizinischen Community und bei Abiomed, die uns dabei geholfen haben, diesen Meilenstein zu erreichen.“
Im Juni 2020 genehmigte die FDA die frühe Machbarkeitsstudie (EFS) für die Impella ECP. Im Rahmen der EFS wurden bisher 54 Patienten behandelt. Einige dieser Patienten wurden nach dem Protokoll der klinischen Zulassungsstudie behandelt. Im August 2021 wurde die Impella ECP von der FDA als bahnbrechendes Gerät („Breakthrough Device“) eingestuft. Diese Einstufung zeigt, dass die Impella ECP den strengen FDA-Anforderungen an bahnbrechende Geräte gerecht wird. Die klinische Impella ECP-Zulassungsstudie (Impella ECP Pivotal Clinical Trial) wurde am 2. März 2022 von der FDA genehmigt und wird bis zu 217 Patienten in den USA aufnehmen. Weitere Informationen zur Zulassungsstudie finden Sie hier.
Die Impella ECP ist ein Gerät in der Erprobung, dessen Einsatz durch US-Bundesgesetze auf Anwendungen zu Forschungszwecken beschränkt ist.
ÜBER ABIOMED
Abiomed (Nasdaq: ABMD) mit Sitz in Danvers, Massachusetts (USA), ist ein führender Anbieter von Medizintechnik zur Kreislaufunterstützung und Oxygenierung. Unsere Produkte entlasten das Herz und unterstützen seine Erholung durch die Verbesserung des Blutflusses und stellen eine ausreichende Sauerstoffversorgung bei Patienten mit Atemwegsversagen sicher. Weitere Informationen erhalten Sie im Internet unter abiomed.com.
ZUKUNFTSGERICHTETE AUSSAGEN
Zukunftsgerichtete Aussagen unterliegen Risiken und Unwägbarkeiten, wie sie in den regelmäßigen Berichten von Abiomed, die bei der Securities and Exchange Commission eingereicht werden, beschrieben sind. Die tatsächlichen Ergebnisse können erheblich von den erwarteten Ergebnissen abweichen.
Die Ausgangssprache, in der der Originaltext veröffentlicht wird, ist die offizielle und autorisierte Version. Übersetzungen werden zur besseren Verständigung mitgeliefert. Nur die Sprachversion, die im Original veröffentlicht wurde, ist rechtsgültig. Gleichen Sie deshalb Übersetzungen mit der originalen Sprachversion der Veröffentlichung ab.
Contacts
Media Contact:
Jenny Leary
Associate Director, U.S. Communications
+1 (978) 882-8491
jleary@abiomed.com
Investor Contact:
Todd Trapp
Executive Vice President and Chief Financial Officer
+1 (978) 646-1680
ttrapp@abiomed.com